
Eletromagnetismo no Ensino Médio
Conceitos e perguntas principais que podem surgir durante a realização ao experimento Pilha de Daniell
Shizue
Interpretação básica do experimento:
1. Os eletrodos estão em compartimentos separados:
a transferência de elétrons indireta requer que oxidante
e redutor fiquem.
2. Do mesmo modo que na pilha de Volta, a reação química
[ Zn0 ![]() Zn2+
+ 2 e- ] é a fonte de elétrons para a pilha de Daniell.
É nessa reação que consiste a "transformação
da energia química em energia elétrica". A energia
provém da transformação do zinco em sulfato de zinco.
O zinco vai sendo consumido.
Zn2+
+ 2 e- ] é a fonte de elétrons para a pilha de Daniell.
É nessa reação que consiste a "transformação
da energia química em energia elétrica". A energia
provém da transformação do zinco em sulfato de zinco.
O zinco vai sendo consumido.
3. A utilização da superfície porosa ou da ponte
salina, que é responsável pelo fechamento do circuito elétrico,
põe em contato as duas soluções chamadas de eletrólitos,
onde as cargas livres passam de um eletrólito a outro, uma vez
que a quantidade ou concentração dessas cargas livres afeta
diretamente o fluxo de elétrons no fio do circuito externo.
4. Para que a corrente circule pelo sistema, é necessário
que o circuito esteja fechado. Pelo fio metálico movimentam-se
os elétrons que unem os eletrodos metálicos e pela ponte
salina, os íons, constituindo uma fonte de energia eficiente.
O Zn, mais reativo, tem maior tendência a oxidar-se que o Cu, isto
é, Zn tem maior poder redutor, já que tem maior facilidade
em perder elétrons.
Obs.:
a. A reatividade de um elemento químico está associada à
sua maior ou menor facilidade e ganhar ou perder elétrons.
b. As reatividades comparativas desses elementos foram determinadas experimentalmente
e são conhecidas por Filas de reatividade.
c. Através de uma série de experimentos envolvendo vários
metais e o hidrogênio, foi estabelecida a Fila e reatividade:
K > Na > Li > Ca > Mg > Al > Zn
> Fe > Ni > Pb > H
> Cu > Hg > Ag > Pt > Au
Os metais menos reativos que o H são considerados metais nobres.
- podemos canalizar aquela tendência espontânea que os
átomos de Zn possuem de ceder elétrons para os íons
Cu2+
Monta-se um eletrodo de Zn (placa de Zn em uma solução
de ZnSO4) e um eletrodo de Cu (placa de Cu em uma solução
de CuSO4) ligados por um fio condutor. Cada tipo de elemento
químico possui um potencial, uma "tendência" para
perder ou atrair elétrons.
Esta "tendência" é chamada Potencial de oxidação
e é medida em Volts ( V ).
Podemos encontrar os valores do potencial de oxidação de
alguns elementos em tabelas. No caso da reação entre o Zn
e o sulfato de cobre II ( sulfato cúprico - cobre de Nox = 2+ ),
temos:
EZn/Zn2+ = + 0,76 V
ECu/Cu2+ = - 0,34 V
Pode-se perceber que o potencial de oxidação do Zn é
maior que o potencial do Cu. Portanto, somente há reação
quando o Zn0 (zinco metálico) puder oxidar-se. Ao Cu2+
(cátion), de menor potencial, não há opção
senão reduzir-se.
Podemos calcular a ddp pela diferença absoluta entre os potenciais
de oxidação dos elementos.
ddp = maior - menor
ddp = ( EZn/Zn2+ ) - ( ECu/Cu2+
)
ddp = (+ 0, 76 V ) - ( - 0, 34 V )
ddp = + 0,76 V + 0,34 V
ddp = + 1,10 V
- os 2 processos representados:
1. Semi-reação de oxidação - pode ser expressa
pela equação:
Zn0 ![]() Zn2+ + 2 e-
Zn2+ + 2 e-
2. Semi-reação de redução - pode ser expressa
pela equação
Cu2+ + 2 e- ![]() Cu0
Cu0
- as semi-reações constituem uma análise microscópica,
então, podemos justificar cada semi-reação:
Cada átomo de Zn0 da placa, ao passar para a solução,
deixa 2 elétrons na placa.
Esses elétrons saem espontaneamente para o fio condutor e chegam
até a placa de Cu. Isso explica o aparecimento do fluxo de elétrons,
acusado pelo amperímetro. É esse fluxo que faz o aparelho
funcionar.
Os elétrons que chegam à placa de Cu0 atraem
os íons Cu2+ da solução que, em contato
com a placa, recebem esses elétrons e se convertem em átomos
Cu0 , que se depositam na placa.
O átomo neutro Cu0 assim formado fica anexado à
placa, ou seja, passa a fazer parte dela.
- o que ocorre exatamente em cada eletrodo, para que apareça
o fluxo de elétrons:
. Eletrodo de Zn
- os átomos da placa de Zn0 passam para a solução
na forma de cátions (Zn2+)
- Zn2+ aumenta
- a placa se desgasta
. Eletrodo de Cu
- os íons Cu2+ colidem com a placa, recebem elétrons
e ficam anexados ( Cu0 )
- Cu2+ diminui
- a massa da placa aumenta
- análise química: o que acontece com os átomos
da placa e os íons da solução:
. a placa de Zn fica corroída
. a massa da placa de cobre aumenta
. a concentração de Zn2+ aumenta
. a concentração de Cu2+ diminui
- sentido dos elétrons
Os elétrons circulam do eletrodo de maior potencial de oxidação
para o de menor potencial de oxidação: os elétrons
vão do zinco para o cobre.
- pólos da pilha
Pólo negativo - o de maior potencial de oxidação
Zn - onde ocorre oxidação
Pólo positivo - o de menor potencial de oxidação
Cu - onde ocorre redução
A placa de zinco cede elétrons é o ânodo ou terminal
negativo e a placa de cobre metálico, que recebe elétrons
é o cátodo ou terminal positivo. O sentido da corrente elétrica
que passa pelo condutor é do ânodo para o cátodo.
- A pilha de Daniell é representada pela seguinte notação:
Zn0/Zn2+ // Cu2+/Cu0
Ânodo - Ponte Salina - Cátodo
- Como os elétrons de zinco chegam à placa de cobre
A placa de zinco ao entrar em contato com a solução
ZnSO4 sofre oxidação: perde 2 elétrons
e começa a dissolver-se, isto é, íons positivos de
zinco Zn2+ deixam a placa e entram na solução.
A energia química que é desenvolvida por esta reação
é a responsável pela geração da corrente elétrica
e pela energia elétrica a ela associada. O estudo químico
desta reação mostra que ela é uma reação
espontânea. Este é o motivo pelo qual, ao se fechar o circuito
externo de uma pilha, a corrente elétrica começa a fluir
automaticamente.
Cada Zn2+ ao entrar na solução, deixa na placa
de zinco, dois elétrons; desse modo, a placa de zinco, por causa
dos elétrons ali deixados, ficou com excesso de carga negativa.
Os íons positivos de zinco (Zn2+) repelem os íons
positivos de cobre (Cu2+) para a placa de cobre.
À medida que cada Cu2+ chega na placa de cobre, retira
dela 2 elétron e torna-se, um átomo neutro.
A placa de cobre, cedendo elétrons, ficou com excesso de carga
positiva.
Assim, foi criada uma diferença de potencial (tensão elétrica)
entre as placas de zinco e de cobre.
Quando ligadas a um condutor, dá-se a passagem de elétrons
do zinco para o cobre. Os elétrons fluem do eletrodo onde ocorre
oxidação (Zn0) para o eletrodo onde ocorre redução
(Cu0).
Se colocarmos nesse fio um aparelho denominado voltímetro, podemos
medir a força eletromotriz. O valor indicado pelo voltímetro,
em Volts (V), corresponde à força eletromotriz da pilha.
Nas pilhas comuns este valor aparece na embalagem externa da pilha.
- Energia transformada na pilha
Agora podemos compreender claramente o que significa a expressão:
"a pilha transforma energia química em energia elétrica".
Significa que a reação química [Zn0 ![]() Zn2+ + 2 e-] liberta dois elétrons, isto é, liberta
carga elétrica.
Zn2+ + 2 e-] liberta dois elétrons, isto é, liberta
carga elétrica.
Com o funcionamento da pilha a reação continua e o zinco
vai sendo consumido, e transformado em sulfato de zinco. Podemos então,
dizer que a energia elétrica fornecida pela pilha provém
da energia química do consumo do zinco. Depois de algum tempo de
uso, o zinco desaparece. Para restaurar a pilha precisamos usar nova lâmina
de zinco.
Como funciona a pilha?
No eletrodo de Zn ocorre a seguinte reação:
1. Ocorre a oxidação do zinco, que perde 2 elétrons
e transforma-se num íon Zn2+.
2. O eletrodo de cobre atrai estes 2 elétrons que passam
pelo fio sob a forma de corrente elétrica.
Potencial de redução (Ered): é a capacidade
de atrair elétrons que cada íon metálico em solução
apresenta.
3. Assim que o eletrodo de cobre recebe os 2 elétrons, os íons
livres Cu2+ presentes na solução são,
então, atraídos para o eletrodo de cobre carregado.
Estes íons são reduzidos ao receber os 2 elétrons,
transformando-se em Cu0 depositando-se no eletrodo sob a forma
de metal, de maneira a igualar as cargas negativas, ou seja, equilibrando
as cargas.
4. Os íons positivos Zn2+ produzidos pelo eletrodo de
zinco passam para a solução de sulfato de zinco.
Por sua vez, para cada íon Cu2+ depositado, um íon
de Zn2+ é libertado do eletrodo de zinco para a solução
doando 2 elétrons para o eletrodo de cobre
No eletrodo de Cu ocorre a seguinte reação:
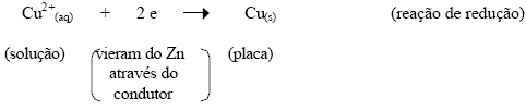
A dissolução de átomos de zinco
para sua forma iônica, corresponde ao depósito de íons
de cobre em sua forma metálica.
Reação Global:
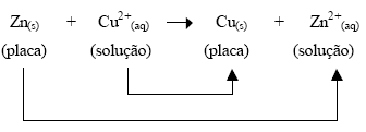
1. Os 2 elétrons fornecidos pelos átomos
de zinco passam pelo fio de interligação, fornecendo corrente
elétrica para o dispositivo a ele ligado.
2. Se não houvesse contato entre as duas soluções
(chamadas de eletrólitos), através do vaso poroso ou da
ponte salina, os elétrons passariam rapidamente para o cobre (que
tende a receber elétrons do zinco) e, ao se concentrarem na placa
de cobre, as forças de repulsão interromperiam o fluxo de
elétrons. O fluxo dessa maneira interrompe-se muito rapidamente
e não há como aproveitar a geração de energia
elétrica.
3. Banhando-se os eletrodos em eletrólitos, que são soluções
condutoras geralmente salinas ou ácidas, e permitindo que essas
duas soluções troquem íons, haverá fluxo de
cargas em ambas direções, permitindo que o efeito de geração
de corrente elétrica perdure até que o eletrodo de zinco
se consuma (pois o eletrodo de zinco corrói-se no processo). Ainda,
pode haver formação de hidrogênio no eletrodo de cobre
e haverá depósito de óxidos no eletrodo de zinco,
o que servirá de barreira entre o metal e o eletrólito.
Este fenômeno é conhecido como polarização
dos eletrodos.
4. Com o tempo, íons Zn2+ vindos do eletrodo de zinco,
combinados com cargas que passam através da ponte salina, aumentarão
a concentração de sulfato de zinco em um recipiente ou meia-célula,
enquanto que paralelamente haverá redução de concentração
na solução de sulfato de cobre, por perda de íons
Cu2+. Isso provocará diminuição gradual
da corrente elétrica, até que a reação cesse
e pilha é considerada esgotada. Os íons Zn2+
acabarão por finalmente alcançar o eletrodo de cobre, envolvendo-o
e bloqueando qualquer movimento de íons Cu++, polarizando
este eletrodo.
5. Pela reação global, conforme a pilha vai funcionando,
percebe-se que:
a. A placa de Zn sofre corrosão (desgaste) com aumento da concentração
de Zn2+ em solução.
b. Aumento de massa da placa de cobre, devido a deposição
de Cu2+ formando Cu0 , diminuindo a concentração
de Cu2+ , com o clareamento da coloração azul
da solução.
Parede porosa (de porcelana, por exemplo)
Tem por função manter constante a concentração
de íons positivos e negativos, durante o funcionamento da pilha.
Ela permite a passagem de cátions em excesso em direção
ao cátodo e também a passagem dos ânions em direção
ao ânodo. Atravessando a parede porosa, os íons em constante
migração estabelecem o circuito interno da pilha.
Ponte salina - solução eletrolítica que não
participa diretamente das reações nos eletrodos.
Qual é o papel da ponte salina?
À medida que o Zn0 se oxida, como a solução
vai ficando mais rica em íons Zn2+, para que a neutralidade
de carga seja mantida, cátions devem se mover no sentido da solução
CuSO4 e (ou) ânions devem chegar à solução
de Zn2+.
Além disso, cátions K+ dirigem-se à semi-cela
do cobre e o ânion Cl- à do zinco.
Tudo isso ocorre, ao mesmo tempo, que os elétrons fluem no fio
graças à reação da pilha.
Para manter a neutralidade elétrica (equilíbrio elétrico)
íons migram através da ponte salina: cargas positivas e
negativas na solução, íons Zn2+ migram
para o eletrodo de Cu e íons SO42- migram
para o eletrodo de Zn, através da ponte salina.
Importante
1. Aparecimento da ddp inicial, entre cobre e zinco.
Inicialmente aparece uma diferença de potencial inicial: o zinco
liberta íons positivos de zinco na solução de sulfato
de zinco, e retém elétrons, ficando negativo em relação
à solução. O cobre liberta íons positivos
de cobre, na solução de sulfato de cobre, e retém
elétrons, ficando negativo em relação à essa
solução. Mas, o zinco liberta mais íons do que o
cobre, retendo mais elétrons. Por isso, o zinco fica mais negativo
que o cobre.
2. Manutenção da ddp através da superfície
porosa ou ponte salina.
É devida à ação dos sulfatos de cobre e de
zinco.
a. Sulfato de cobre
Este sal se dissocia em íon de Cu2+ e íon SO42-:
CuSO4 ![]() Cu2+ + SO42-
Cu2+ + SO42-
O íon Cu2+ se dirige para a placa de cobre; aí
recebe elétrons que estão chegando pelo condutor e se transforma
em cobre metálico Cu0, depositando no eletrodo de cobre. Este eletrodo
vai crescendo à medida que a pilha funciona.
O íon SO42- atravessa a parede porosa ou
ponte salina e se dirige para a placa de zinco. Aí reage com o
Zn0 e produz sulfato de zinco, libertando-se 2 elétrons
na reação: [Zn0 + SO42-
![]() ZnSO42-
+ 2 e-]
ZnSO42-
+ 2 e-]
Esses 2 elétrons, o zinco os cede ao condutor , que os transporta
para a placa de cobre. O sulfato de zinco se dissolve. Do mesmo modo que
na pilha de Volta esta reação química é a
fonte de elétrons para a pilha de Daniell. É nessa reação
que consiste a "transformação da energia química
em energia elétrica". A energia provém da transformação
do zinco em sulfato de zinco. O zinco vai sendo consumido.
b. Sulfato de zinco
Este sal se dissocia em íon de Zn2+ e íon SO42-
: ZnSO4 ![]() Zn2+
+ SO42-
Zn2+
+ SO42-
O íon SO42- se dirige para a placa de zinco
e reage com ele de acordo com a equação:
Zn0 + SO42- ![]() ZnSO42- + 2 e- forma-se mais sulfato de zinco, que
se dissolve e libertam mais 2 elétrons.
ZnSO42- + 2 e- forma-se mais sulfato de zinco, que
se dissolve e libertam mais 2 elétrons.
Quanto aos íons Zn2+, alguns se unem novamente com íons
SO42- e reconstituem moléculas de sulfato
de zinco. Mas, a maioria deles permanece na solução sob
a forma de íons. A medida que a pilha funciona, o número
de íons Zn2+ ao redor do eletrodo de zinco vai aumentando.
Como esse eletrodo é negativo e os íons Zn2+
são positivos, o aumento da quantidade desses íons faz diminuir
a ddp entre o cobre e o zinco. À medida que funciona, a pilha de
Daniell piora.