
Eletromagnetismo no Ensino Médio
EXPERIMENTO do NITRATO de PRATA
Shizue
|
Introdução |
 |
Durante a fabricação de componentes
metálicos, esses materiais passam por um processo de fusão
seguido de solidificação.
Como não nos é possível observar
a formação de dendrites por solidificação
metálica, podemos observar o crescimento dendrítico, através
de uma reação de óxido-redução e por
analogia visual. Durante o crescimento, se verifica uma deposição
de cristais de prata (Ag0) sobre um fio de cobre (Cu0).
|
Materiais * Se usarmos álcool (e um pedaço de
algodão) para limpar melhor o fio de cobre antes de inseri-lo
na solução, melhora efeito. |
 |
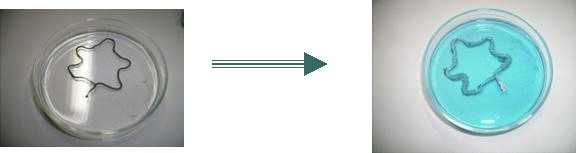
Procedimento inicial
Mergulhamos um fio de um metal mais reativo, o Cu0 - enrolado de uma forma
decorativa - em uma solução aquosa contendo os cátions
de um metal menos reativo Ag+.
Em um recipiente com nitrato de prata em solução, coloque
o fio de cobre de forma que fique totalmente imerso e observe.
Registro da observação
1. Após a adição de nitrato de prata verifica-se
de imediato o início da deposição da prata sólida
sobre o fio de cobre.
2. Observam-se algumas ramificações.
passados alguns minutos as ramificações estavam maiores
(observáveis a olho nu)
Com a lupa:
Verifica-se que estavam bastante ramificadas e que se sobrepunham umas
às outras.
Facilmente se notava as ramificações sucessivas no braço
primário.
3. A solução incolor vai ficando azulada
4. Após 1h nota-se o enegrecimento das dendrites, resultado da
oxidação da prata (efeito
fotográfico)
Interpretação
Por que se formam os fios compridos de prata?
a. a deposição da prata sobre o fio de cobre inicia-se pela
formação de pequenos núcleos
microscópicos
b. os pequenos núcleos em seguida, crescem mais acentuadamente,
segundo certas
orientações do espaço dando origem a braços
c. os braços primários ramificam-se em braços secundários
e por sua vez em braços
terciários... e assim, sucessivamente.
d. estas formações arborescente
são os dendrites.

Por que formam cristais?
Em nível microscópico, no átomo de prata metálica,
a atração entre os íons acaba produzindo aglomerados
com formas geométricas bem definidas, que chamamos retículo
cristalino, no qual ficam os elétrons livres, cedidos pelos respectivos
átomos.
Os metais são formados por seus cátions, mergulhados em
um "mar de elétrons livres"
Cristal é todo material sólido cujas partículas (átomos,
íons ou moléculas) se encontram regularmente organizadas
no espaço, segundo um determinado arranjo geométrico, compondo
uma estrutura resistente.
No processo de cristalização, formam-se inicialmente pequenos
cristais, aos quais os demais íons tendem a se agrupar. A esse
processo, os químicos chamam de crescimento de cristais.
Por que ocorre crescimento de cristais?
Os pequenos núcleos microscópicos se formam porque os íons
Ag+ da solução aquosa vão gradualmente passando para
a forma de Ag metálico, devido à reação de
óxido-redução.
Os braços se ramificam, se sub-ramificam... e assim, sucessivamente,
vão crescendo e engrossando com a formação de inúmeros
grãos cristalinos, normalmente de reduzidíssimas dimensões,
devido às forças de atração eletrostática.
- na prática, essa interação ocorre por todo o espaço
onde cargas elétricas de sinais
opostos se atraem.
Neste processo de ramificação, os braços adjacentes
entrelaçam-se de modo que o crescimento de alguns cristais é
limitado pelos outros.
Surge assim uma estrutura policristalina em que cada cristal resulta de
um determinado núcleo.
Cada um dos cristais constituintes deste policristal é denominado
de grão, sendo as interfaces entre os diferentes grãos,
o limite de grão.
REAÇÃO de ÓXIDO-REDUÇÃO
Semi-reação:
Cu0(s)
![]() Cu2+(aq) + 2e-
E0 = - 0,34 V
Cu2+(aq) + 2e-
E0 = - 0,34 V
Reação global: 2Ag+(aq) + Cu02
![]() Ag0(s) +
Cu2+(aq) E0 = + 0,46 V
Ag0(s) +
Cu2+(aq) E0 = + 0,46 V
OBS. Não representamos o ânion (NO3-) na reação
porque ele não participa ativamente do processo.
- nesta reação não houve influência do íon
nitrato, resultante da solubilização do sal inicial
(nitrato de prata)
Inicialmente, o cobre se encontrava na sua totalidade na
forma cristalina (cobra metálico) e a prata na solução
aquosa.
A reação de óxido-redução está
relacionada a uma transferência de elétrons entre os átomos
e íons das substâncias reagentes.
O metal Cu0 irá doar elétrons aos cátions Ag+ da
solução, que sofrerão redução e se
depositarão na forma de cristais metálicos.
Neste caso, o oxidante é a prata, que recebe elétrons cedidos
pelo cobre, o agente redutor.
Assim, os íons Ag+ presentes na solução, ao sofrerem
redução depositam-se sobre a forma de Ag metálico
sobre o fio de cobre e alguns íons Cu2+ vão conseqüentemente
para a solução.
a concentração de íons cobre em solução
vai aumentar (o cobre hidratado tem cor azul) e, conseqüentemente,
a concentração de íons prata vai diminuir.
OBS. Por que a mão fica preta em contato com a solução
de nitrato de prata?
Nitrato de prata - Ag NO3
- cristais incolores
- sensíveis à luz e à matéria orgânica,
tornado-se cinza-escuros na presença de ambos.
- é inodoro
- tem sabor amargo
- é altamente tóxico
- apresenta tolerância máxima de 0,01mg/m3 de ar
- causa manchas escuras na pele
Quando o cobre é exposto à ação do oxigênio
e da umidade, pode ocorrer formação de azinhavre, de cor
verde, uma mistura (bastante tóxica) de óxidos e hidróxidos
de cobre.

Conteúdo de Ciência Presente no Experimento - outras questões que podem surgir...
Na dissociação do nitrato de prata em íons de prata Ag+ e nitrato NO3- quando colocados em água (solução aquosa), um elétron da prata passa para o grupo NO3. E a água, que parte tem nisso? Os íons positivos de prata ficam rodeados de água, especialmente da parte negativa (oxigênio) da molécula de água. Por que a água não dissocia também em H+ e OH-(Como na eletrólise)?
Colocando o fio de cobre nessa solução, um elétron do cobre passa para a prata, que então fica neutra e forma cristais de prata. O cobre, por sua vez, perdeu um elétron e foi para a solução (ionizado), deixando a solução azul. A solução fica azul porque os íons de cobre caem na solução e o cobre ionizado em solução deixa-a azul.
A prata vai até lá, encontrando o cobre? A prata está lá, pois está na solução aquosa em que o cobre está imerso.
Por que se formam os fios compridos de prata? A prata sólida é um metal, portanto é condutora (permite passagem de elétrons em sua estrutura), e o cobre sólido também. Os elétrons livres do sistema prata-cobre (metálicos), ficam disponíveis nas extremidades da prata também - e principalmente nas pontas (poder das pontas). Assim, quando um íon de prata se aproxima da prata sólida que está cobrindo o fio de cobre, esse íon atrai um dos elétrons livres do sistema e "gruda-se" no sólido. Algum átomo de cobre do fio é então expulso da estrutura (sem um elétron) para que esta se mantenha neutra. Assim se formam os fios compridos de prata que crescem formando o cristal de prata, e assim o fio de cobre é corroído, de forma que no final reste um "buraco" no meio da estrutura cristalina de prata, onde estava o cobre metálico.

Por que quando o fio de cobre colocado na solução é mais fino, os fios de prata que se formam são mais compridos? Porque um fio mais fino tem menos área de contato, então sobra aos íons de prata grudarem nas pratas sólidas que já cobrem o fio de cobre.
Por que essa reação é de oxi-redução? A prata recebeu elétrons, então reduziu; e o cobre oxidou, porque ganhou elétrons. Um químico escreveria essa reação de outra forma:
AgNO3 + Cu0
![]() Ag0 + CuNO3
Ag0 + CuNO3
... mas o Cu só se junta com o NO3 se a água evaporar, então o mais correto, especialmente do ponto de vista explicativo para o aluno, é deixar a reação com os íons separados mesmo:
Ag+ + NO3- + Cu0
![]() Ag0 + Cu-
+ NO3-
Ag0 + Cu-
+ NO3-
... sendo que o NO3- é irrelevante, pois não muda da situação inicial para a final.
Por que a mão fica preta quando em contato com essa solução? Não sabemos. Achamos que ou foi por causa do nitrato de prata. É alguma reação de algum dos íons com a pele.
A prata, em contato com o ar, fica verde (ou seja, óxido de prata é verde). Em contato com a pele, fica preta (Qual será a reação?).