
Eletromagnetismo no Ensino Médio
Pilha de Volta (montagem alternativa)
Maria Helena
Este experimento foi utilizado num curso para EJA e ocupou quatro aulas
1. Material necessário
Copo de plástico, placas de cobre (1) e zinco (1), solução de sulfato de cobre, dois fios (com jacarés), lâmpada de lanterna.
2. Objetivos
O aluno deverá ser capaz de explicar o que acontece microscopicamente no circuito (fios e pilha) para que a lâmpada acenda.
O aluno deverá ser capaz de dizer por que a pilha é a responsável pelo aparecimento e manutenção da corrente elétrica.
3. Procedimento
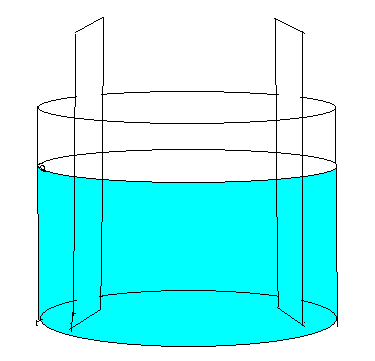
1) Montagem da pilha de Volta.
A pilha de Volta era originalmente uma pilha de discos:
pares de cobre-zinco, cada um separado dos outros por discos de papelão
umedecidos com água acidulada.
Mas nossa montagem será a seguinte: mergulhamos em um recipiente
que contém solução de sulfato de cobre uma placa
de zinco e outra placa de cobre.
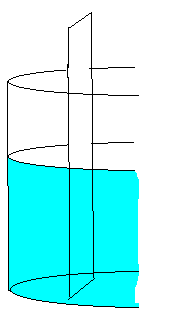
2) Como funciona a placa de Volta.
O sulfato de cobre quando em contato com a água é dissociado nos íons ( S04-2 ) e (Cu-2 ). Estes íons apresentam um movimento incessante e aleatório no interior da solução.
- A placa de Zinco
O zinco tem maior potencial de oxidação que o cobre. Reage mais facilmente com a solução porque doa mais facilmente seus elétrons. É o polo (-) da pilha.
- A placa de cobre
O cobre tem maior potencial de redução que o zinco.Tem maior facilidade para receber elétrons. É o polo (+) da pilha.
Pelo fato de as placas apresentarem características diferentes, acontece o seguinte:
O átomo de zinco da placa doa dois elétrons
( 2e- ) e fica ionizado ( Zn+2 ).
O íon ( S04-2 ) ao se chocar com a placa de zinco "captura
o íon (Zn+2 ) formando com ele o sulfato de zinco levando-o
para a solução onde ocorre novamente a dissociação.
Os elétrons doados pelo zinco são "capturados"
pelo íon de cobre ( Cu+2 ) formando o cobre metálico
neutro que se deposita sobre a placa de zinco.
Podemos representar o que foi dito assim:
Zn + CuSO4![]() ZnS04
+ Cu
ZnS04
+ Cu
Na placa de cobre, os dois elétrons doados pelo
átomo são "capturados" pelo íon de zinco
(Zn+2) se neutralizando e também se depositando sobre a placa de
cobre. O íon
(S04-2) ao "capturar" o íon Cu+2 da placa de cobre forma
com ele o sulfato de cobre levando-o para a solução onde
ocorre a dissociação.
O que foi dito pode ser representado assim:
Cu + ZnS04 ![]() CuS04
+ Zn
CuS04
+ Zn

Como o zinco tem maior potencial de oxidação que o cobre, rapidamente a placa de zinco fica escura, indicando que houve um depósito muito grande de cobre, o que impede o funcionamento da pilha.
Algumas dicas
Para que não haja necessidade por parte dos alunos do manuseio
do sulfato de cobre o professor poderá levar a solução
já preparada e dizer, ou até mesmo preparar um pouco da
solução como demonstração para que os alunos
vejam o sulfato de cobre antes de ser dissolvido em água. Enquanto
o sulfato de cobre está sendo dissolvido em água o professor
poderá levar os alunos a pensarem sobre o que está acontecendo
com o sulfato. O professor passará nos grupos e colocará
a solução até a metade nos copos que podem ser de
plástico. As placas deverão estar muito bem limpas, caso
contrário os resíduos existentes nas placas impedirão
o contato das placas com a solução impedindo que as reações
ocorram. Outro cuidado que o professor deverá ter é que
a placa de zinco, tendo maior potencial de oxidação, reage
muito rapidamente com a solução, e fica rapidamente coberta
com cobre metálico o que impede que as reações continuem.
Sendo assim, a lâmpada apagará rapidamente. Portanto, antes
de mergulhar as placas na solução, os fios e a lâmpada
já devem estar conectados a elas e em seguida serem mergulhadas.
4. Comentários finais
Os cuidados que foram descritos no procedimento podem ser usados pelos professores como situações que levem os alunos a pensarem sobre o que está acontecendo e conseqüente motivação para discussões. Por exemplo, o professor pode dar para diferentes grupos placas limpas e outras não limpas. Para um grupo a lâmpada acenderá para outros não. Este conflito poderá gerar uma discussão que levará os alunos a pensarem sobre o que está acontecendo. A idéia de que entre as placas e a solução ocorrem reações químicas podem ser deduzidas dessa discussão e que os resíduos é que as impedem de acontecerem.
Ver o planejamento