
 |
|---|
Microscopia Óptica
Microscopia Óptica de Fluorescência
Conceitos Básicos (01/02/2013)
Em um microscópio óptico de luz composto, a radiação
atravessa a amostra (modo de transmissão)
ou reflete (modo reflexão) a superfície de uma amostra, sendo difratada, recolhida pela lente objetiva e formando uma imagem aumentada que chega aos olhos pela lente ocular ou
que chega à uma CCD.
A lente condensadora é utilizada no modo transmissão e é responsável por focalizar a luz vinda de um iluminador.
A denominação composto refere-se ao fato de que o aumento final é uma composição dos aumentos da
lente objetiva e da ocular (ou CCD). O aumento final é então M = M(obj) x M(ocu). Dessa forma, se estamos
usando uma lente objetiva de M(obj) = 100 X, e M(ocu) = 10 x, o aumento final é de M = 100 x 10 = 1000 x. No caso
da CCD, geralmente M(ccd) = 12 x. Nesse caso, para a mesma objetiva, o aumento final seria de M = 1200x.
O comprimento de onda da radiação (luz visível) é de cerca de 700 nm e é um dos fatores que define a resolução da técnica.
O poder de resolução do microscópio, considerando-se objetos pontuais, é definido por d = 0,61 λ/AN (Eq. 1), onde AN é a abertura
numérica da lente objetiva, d é a distância mínima resolvida, em μm, e λ é o comprimento de onda da radiação, também em μm.
A expressão é essa também (Eq. 1) no caso de microscopia de campo claro no modo transmissão se a abertura numérica
da lente condensadora for maior ou igual à abertura numérica da lente objetiva, ou AN(cond) >= AN(obj). Exemplo: se uma objetiva de 10x
tem AN(obj)=0,25 e a configuração é tal que AN(cond) = 0,30, temos d = (0,61 x 0,7 μm)/0,25, d=1,71 μm.
Mas se a abertura numérica da lente condensadora for menor do que a abertura numérica da lente objetiva, AN(cond) < AN(obj), é utilizada
a expressão d = 0,61 λ/(AN(cond) + AN(obj) (Eq. 2). Como exemplo, se AN(obj) = 0,25 e AN(cond) = 0,20, temos
d = (0,61 x 0,7 μm)/(0,20 + 0,25), d=0,95 μm. Nota-se que a resolução melhora quando AN (cond) < AN(obj), razão pela qual
configuramos a lente consensadora (que possui AN variável) como AN(cond) ~ 0,8 * AN(obj).
As equações 1 e 2 descrevem o critério de Rayleigh para que dois pontos de difração espaçados no plano de imagem sejam resolvidos.
Pelo critério de Rayleigh, dois objetos pontuais adjacentes são resolvidos quando o centro do disco de Airy (região circular de
difração de um ponto bem focalizado) de um ponto coincide com o primeiro mínimo do disco de Airy de outro ponto no ponto de imagem (figura 1).

Microscopia Óptica de Fluorescência (18/06/2013)
Fotoluminescência é nome que se dá ao efeito de uma amostra absorver e re-erradiar luz. Se a luz é interrompida, mas a re-emissão persiste por alguns segundos,
o efeito é chamado de fosforescência. A fluorescência ocorre quando a re-emissão ocorre apenas durante a absorção da radiação excitante.
O intervalo de tempo entre os processos de absorção e re-emissão é da ordem de um milionésimo de segundo. Quando uma molécula fluorescente
absorve um fóton de comprimento de onda adequado, um elétron é excitado para um estado de energia mais alto e quase imediatamente volta ao
seu estado inicial. Nesse processo, a molécula pode liberar a energia absorvida como um fóton fluorescente. Como um pouco da energia absorvida
é perdida no processo, o fóton fluorescente emitido possui uma menor freqüência de vibração, ou seja, um comprimento de onda maior do que do
fóton inicialmente absorvido. Esse efeito forma a base da microscopia de fluorescência.
Através da Microscopia de Óptica de Fluorescência é possível visualizar moléculas específicas que
fluorescem na presença de radiação excitante. A técnica pode ser usada para determinar a quantidade,
distribuição e dinâmica de macromoléculas específicas em células, possibilitando o estudo de diversos mecanismos celulares.
Geralmente, as amostras não são auto-fluorescentes e o uso de corantes chamados fluoróforos (ou fluorocromos) é necessário para torná-las fluorescentes.
Os fluoróforos são moléculas que absorvem fótons com energia de determinado espectro de excitação e re-emitem fótons com energia em determinado espectro de emissão (ou de fluorescência).
Os espectros de excitação e de emissão possuem um pico de intensidade. A diferença em nanometros entre os picos do espectro de excitação e do espectro de emissão é chamado de desvio de Stokes.
Quanto maior o desvio de Stokes, mais vantajoso é o corante, pois as bandas de excitação e fluorescência são mais fáceis de serem isoladas usando filtros de interferência. Para o fluoróforo DAPI, por exemplo,
o comprimento de onda de absorção referente ao pico de intensidade é de 345 nm, enquanto que o pico de emissão fluorescente ocorre para comprimento de onda de 460 nm, o que dá uma diferença de 115nm (desvio de Stokes).
Outra característica importante de um fluoróforo é a eficiência quântica de emissão de fluorescência, que é a razão entre fótons fluorescentes emitidos e fótons absorvidos. O coeficiente de extinção molar descreve
a capacidade do corante em absorver um fóton e é dado em unidades de absorbância para o comprimento de onda referente ao máximo de intensidade. Outras características relevantes dos fluoróforos são sua resistência à fotodegradação,
sua solubilidade em meio aquoso e sua estabilidade química. Mais de um fluoróforo pode ser utilizado ao mesmo tempo em uma amostra, registrando diferentes estruturas ou processos da amostra. Existem algumas subtâncias naturalmente
fluorescentes em produtos comuns, tais como extrato de espinafre (vermelho), extrato de cenoura (amarelo), leite em pó (azul) e margarina (azul).
O microscópio de fluorescência possui uma série de modificações importantes para se obter imagens brilhantes e bem definidas. Eles possuem filtros especiais e método único
de iluminação para a produção de imagens. Para imagem eficiente de alto contraste, a iluminação e a objetiva são posicionadas do mesmo lado da amostra. Assim, as lentes objetivas funcionam tanto como lentes consensadoras,
entregam a radiação excitante, quanto coletando a luz fluorescente emitida pela amostra. Os filtros são projetados para isolar e manipular dois conjuntos distintos de comprimentos de onda, os de excitação e os de fluorescência (ou emissão).
A banda de comprimentos de onda de excitação (que são curtos) vinda do iluminador e filtros é direcionada para a amostra, enquanto que a banda de comprimentos de onda longos de fluorescência emitida pela amostra forma a sua imagem.
São usadas objetivas de alta abertura numérica para maximizar a coleta de luz e fornecer a melhor resolução e contraste possíveis.
Uma fonte de luz brilhante como uma lâmpada de arco de xenon ou de mercúrio, chamada de epi-iluminador, é necessária já que uma banda fina de comprimentos de onda curtos é usada para excitar os fluoróforos.
A iluminação consiste de uma lâmpada, lentes coletoras, outras lentes e filtros. Quanto à lâmpada, 100 W de mercúrio ou 75 W de xenon são geralmente usadas. Ambas as lâmpadas fornecem a banda entre 400-700 nm,
mas a lâmpada de mercúrio, conhecidamente, possui linhas de emissão bem definidas em 366 (UV), 405, 436, 546 e 578 nm. Essas linhas são úteis para excitar certos fluoróforos, como DAPI, por exemplo. Em 546 nm,
essas lâmpadas são de 10 a 100 x mais brilhantes do que a lâmpada de 100W halogênea, comumente utilizada em microscopia de campo claro e essa vantagem é necessária para a Microscopia de Fluorescência.
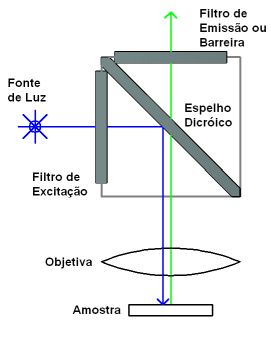
Conjuntos de filtros fluorescentes contendo três filtros essenciais (filtro de excitação, espelho dicróico e filtro de barreira, para emissão)
são montados na forma de um cubo no caminho óptico entre o epi-iluminador e a objetiva (veja figura 2). O filtro de excitação seletivamente
transmite uma banda de comprimentos de onda curtos para excitar o fluoróforo na amostra. O espelho dicróico reflete a luz de comprimento
de onda curto em direção às lentes objetivas e amostra, mas transmite a luz fluorescente de comprimento de onda longo em direção ao detector.
O filtro de barreira transmite a banda de comprimentos de onda fluorescentes, mas bloqueia qualquer comprimento de onda curto de excitação
residual. Os comprimentos de onda fluorescentes formam então a imagem no olho ou na câmera.
Para realizar imagens de fluorescência deve-se saber selecionar corretamente o(s) fluoróforo(s),
os filtros e iluminação adequada, além de avaliar corretamente a qualidade dos sinais de fluorescência.
Deve-se também tentar evitar a fotodegradação, interrompendo a iluminação para a amostra nos momentos em que ela não está sendo observada.
A seguir uma imagem de leite em pó visto em Microscopia de Fluorescência utilizando-se cubo para DAPI (filtro de excitação de 330 nm - 385 nm e
filtro de emissão de 420 nm)

Figura 3 - Imagem de leite em pó visto em Microscopia de Fluorescência
Referências
- http://www.olympusmicro.com/primer/lightandcolor/fluorointroduction.html
- Douglas B. Murphy. "Fundamentals of Light Microscopy and Electronic Imaging". John Wiley & Sons. (2001).